Mengapa Larutan Elektrolit dapat Menghantarkan Listrik?

KOMPAS.com – Larutan elektrolit adalah salah satu jenis larutan yang bersifat sebagai konduktor karena dapat menghantarkan listrik. Larutan elektrolit dapat menghantarkan arus listrik karena ion-ion yang terkandung di dalamnya.
Berikut adalah proses bagaimana larutan elektrolit dapat menghantarkan listrik!
Disosiasi molekul menjadi ion
Dilansir dari Lumen Learning, elektrolit adalah setiap garam atau molekul yang ion-ionnya dapat terdisosiasi jika dilarutkan dalam air.
Garam atau molekul yang dapat terdisosiasi biasanya adalah senyawa dengan ikatan ion (senyawa ionik) dan senyawa kovalen. Misalnya, garam natrium klorida (NaCl) yang merupakan senyawa ionik.
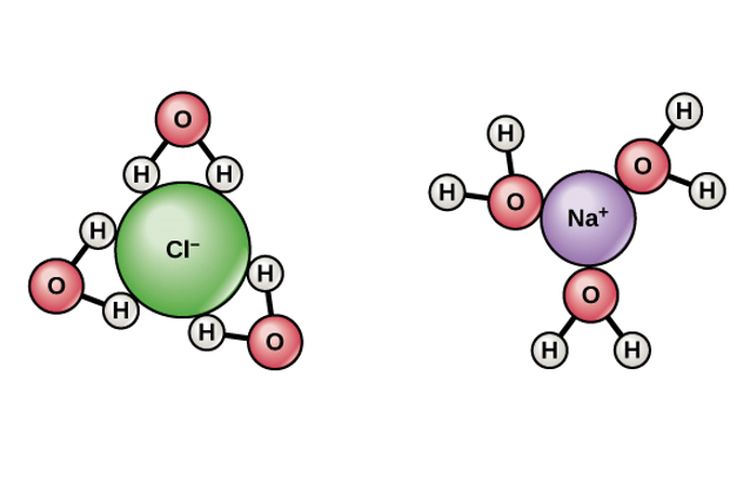
Dilansir dari Encyclopedia Britannica, ketika natrium klorida larut dalam air, atom natrium dan klor terpisah dan bergerak bebas di dalam air sebagai ion bermuatan listrik.
Baca juga: Ciri-ciri Senyawa Ionik
Disosiasi NaCl membuat atom natrium (Na) kekurangan satu elektron dan berubah menjadi ion positif atau kation Na+.
Adapun, atom klor (Cl) mengalami kelebihan satu elektron. Sehingga, berubah menjadi ion bermuatan negatif atau anion Cl-.
Ion-ion bergerak bebas membawa muatan listrik
Pembentukan ion-ion terjadi karena molekul air menyusup di antara senyawa elektrolit. Hidrogen yang lebih positif dalam molekul air menarik ion klorida (anion) yang negatif.
Sedangkan, oksigen yang lebih negatif dalam molekul air menarik ion natrium (kation) yang positif.
Baca juga: Ion: Pengertian, Proses Pembentukan, dan Contoh Ikatannya
Hal tersebut membuat ikatan kuat ion berkurang. Sehingga, ion dapat bergerak bebas di dalam larutan elektrolit. Ion-ion yang bergerak bebas itulah yang menjadi kunci mengapa larutan elektrolit dapat menghantarkan listrik.
Ketika larutan elektrolit di aliri listrik, muatan listrik akan di bawa oleh ion. Ion-ion akan bergerak bebas sembari membawa muatan listrik, mengakibatkan arus listrik mengalir dan listrik dapat dihantarkan dalam larutan.
Sifat konduktif elektrolit ini bergantung pada jumlah ion di dalamnya. Makin banyak ion di dalam suatu larutan elektrolit, maka makin kuat sifat konduktivitasnya atau makin besar listrik yang dapat dihantarkan larutan elektrolit tersebut.
Baca juga: Perbedaan Larutan Elektrolit dan Larutan Non-Elektrolit
Larutan elektrolik dari senyawa kovalen menghantarkan lebih sedikit listrik
Tidak seperti larutan elektrolit senyawa ionik yang merupakan elektrolit kuat, larutan elektrolit senyawa kovalen cenderung lemah dalam menghantarkan listrik.
Dilansir dari Chemistry Libretexts, ketika dilarutkan dalam air sebagian besar senyawa kovalen tetap utuh dan hanya terdisosiasi sedikit.
Artinya, hanya terbentuk sedikit ion (kation dan anion). Sisanya, senyawa kovalen tetap dalam bentuk molekul netral. Sedangkan, molekul netral tidak bisa membawa muatan listrik seperti ion.
Sehingga, lebih sedikit ion yang dapat membawa muatan. Membuat, lebih sedikit arus listrik yang dihantarkan dalam larutan tersebut.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita �����.com WhatsApp Channel : . Pastikan kamu sudah install aplikasi WhatsApp ya.