Teori Asam Basa: Pengertian Para Ahli dan Sifatnya

KOMPAS.com - Bagi mereka yang memiliki sakit lambung, pasti akan merasakan bahwa asam di lambungnya sedang tinggi. Sehingga membutuhkan obat yang bisa meredakan gejalanya.
Salah satu sifat obat lambung adalah sifat basa. Sifat ini bisa menetralkan asam lambung yang tinggi. Tahuah kamu apa itu asam dan basa? Berikut penjelasan teori asam dan basa dari Arrhenius, Bronsted-Lowry, dan Lewis:
Teori Asam Basa Arrhenius
Teori asam basa Arrhenius dikemukakan oleh Swedia Svante Arrhenius pada tahun 1884 menjadikannya teori pertama yang mengklasifikasikan senyawa menjadi asam dan basa.
Dilansir dari Chemguide, menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan sedangkan basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam larutan.
Asam dan basa dapat bereaksi menghasilkan air dan senyawa ionic garam, reaksi tersebut disebut dengan reaksi netralisasi.
Misalnya reaksi asam sulfat (H2SO4) dan kalium hidroksida (KOH) yang menghasilkan air dan senyawa ionic garam kalium sulfat (K2SO4).
Baca juga: Asam Traumalin: Fungsi dan Perannya
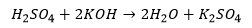 Persamaan reaksi asam sulfat dan kalium hidroksida
Persamaan reaksi asam sulfat dan kalium hidroksida
Asam memiliki sifat melepaskan ion H+, berasa yang asam, tajam, menyengat, dan mengubah kertas lakmus menjadi merah.
Adapun basa memiliki sifat melepaskan ion OH-, berasa yang pahit, bau khas yang tidak tajam menyengat, dan mengubah kertas lakmus menjadi warna biru.
Teori Asam Basa Bronsted-Lowry
Johannes Nicolaus Bronsted dan Thomas Martin Lowry pada tahun 1923 mengembangkan teori Arrhenius dengan nama teori asam basa Bronsted-Lowry.
Dalam teorinya, Bronsted dan Lowry menjawab kekuranngan yang ada dalam teori Arrhenius yang tidak dapat menyimpulkan senyawa asam basa yang reaksinya tidak membentuk larutan.
Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa.
Definisi asam menurut Bronsted-Lowry adalah zat yang dapat menyumbangkan (donor) proton, sedangkan basa adalah zat yang dapat menerima (penerima donor) proton.
Dilansir dari Khan Academy, asam mengandung hidrogen yang dapat berdisosiasi menjadi H+, sedangkan basa harus memiliki setidaknya satu pasang elektron bebas untuk dapat menerima donor proton.
Baca juga: Menentukan Pasangan Asam Basa Konjugasi
Misalnya reaksi antara gas ammonia (NH3) dan gas asam klorida (HCl) yang tidak dapat ditentukan asam basanya dalam teori Arrhenius karena tidak menghasilkan ion hidrogen, dapat dipecahkan dalam teori asam basa Bronsted-Lowry.
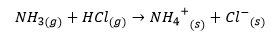 Persamaan reaksi amonia dan asam klorida
Persamaan reaksi amonia dan asam klorida
Dari reaksi terlihat ammonia menerima donor proton karena menerima proton dan berubah menjadi muatan positif. Sehingga ammonia (NH3) merupakan basa dan ion amonia (NH4+) adalah asam konjugasi.































